Rượu là loại thức uống có cồn quá đỗi quen thuộc trong đời sống hằng ngày. Tuy nhiên không phải ai cũng biết về những tính chất cũng như phương pháp điều chế chất lỏng này ra sao. Việc tìm hiểu rõ hơn về công thức hóa học của rượu (cthh của rượu) cũng như các ứng dụng phổ biến sẽ giúp bạn ứng dụng chúng vào thực tế một cách hiệu quả và tối ưu hơn.
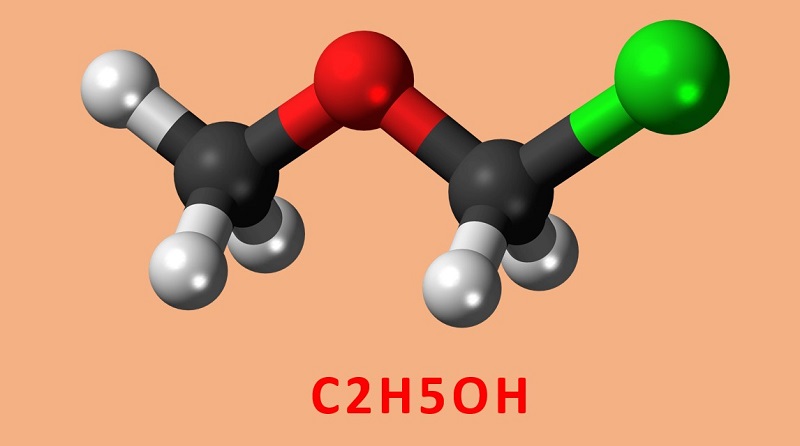
Công thức hóa học của rượu (Ethanol) là: C2H6O hay C2H5O nguyên chất có trong 100ml dung dịch rượu.
1. Công thức hóa học của rượu
Độ rượu hay độ cồn là thuật ngữ dùng để chỉ tỉ lệ etanol, có công thức hóa học là C2H6O hoặc C2H5OH, tồn tại trong 100 ml dung dịch rượu. Chỉ số này được đo lường ở điều kiện nhiệt độ chuẩn (20 độ C) và tính bằng phần trăm (%) theo thể tích. Độ cồn thường xuất hiện trong các loại đồ uống như rượu, bia, và một số loại trái cây lên men.
Rượu có thành phần chính là ethanol với công thức hóa học C2H5OH (hoặc C2H6O) và CH3OH (rượu methanol). Hai loại rượu này đều được lên men và chưng cất. Nếu như rượu ethanol lên men từ tinh bột hoặc đường thì rượu methanol lại lên men từ nguyên liệu có chứa cellulose (gỗ).
- Công thức chung của rượu: C2H6O
- Rượu tên hóa học: Etanol
- Công thức hóa học của Etanol: C2H5O . Trong đó, phân tử Etanol được cấu tạo từ một nhóm Etyl (CH3-CH2-) kết hợp cùng nhóm Hydroxyl (-OH).
- Khối lượng phân tử của Etanol: M=46 g/mol.
Như vậy, rượu có tên hóa học là ethanol (hay còn gọi là ethyl alcohol với công thức hóa học C₂H₅OH). Đây là một hợp chất hữu cơ thuộc nhóm ancol no, nằm trong dãy đồng đẳng của CH3OH. Ethanol cũng là hợp chất hữu cơ đơn giản được biết đến phổ biến trong đời sống với cách gọi là cồn.
>>>Tìm hiểu thêm những kiến thức khác liên quan về rượu:
- Độ rượu là gì? Công thức tính độ rượu?
- Công thức tính thể tích rượu
- Rượu bao nhiêu calo? Uống rượu có béo không?
2. Tính chất vật lý của rượu
Việc tìm hiểu chi tiết hơn về tính chất vật lý của rượu có thể giúp nhà sản xuất hiểu rõ cách mà hỗn hợp này tương tác với các chất khác, từ đó ứng dụng vào thực tiễn hiệu quả hơn.
- Ở điều kiện thường trong khoảng 25 độ C, rượu là một chất lỏng không màu, có mùi thơm đặc trưng mang vị cay và nhẹ hơn nước.
- Nhiệt độ sôi của rượu rơi vào khoảng 78.37 độ C nên rất dễ bay hơi.
- Rượu có thể được hòa tan nhiều vào những chất khác như Iot, Benzen và có khả năng tan vô hạn nếu gặp nước.
- Rượu thường có nhiệt độ sôi cao hơn so với các dẫn xuất của Hidrocacbon có khối lượng phân tử ngang bằng do sở hữu tính chất tạo liên kết từ Hidro.
- Rượu cũng là chất dễ cháy khi ở nhiệt độ trên 365 độ.

3. Tính chất hóa học của rượu
Vì công thức của rượu thuộc dãy đồng đẳng CH3OH và chỉ có duy nhất một nhóm -OH nên rượu sẽ mang tính chất hóa học của Ancol đơn chức.
3.1. Phản ứng với kim loại mạnh
Etanol có thể tác dụng với một số kim loại mạnh như K, Na,… để tạo ra khí H2. Phương trình phản ứng:
2C2H5OH + Na → 2C2H5ONa + H2
3.2. Phản ứng với axit axetic
Phản ứng giữa axit axetic với rượu sẽ tạo ra Este hay còn được gọi là phản ứng Este hóa. Trong quá trình phản ứng của hai hợp chất này có thêm sự hiện diện của axit Sunfuric đặc nên tạo ra thêm nước.
C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O
3.3. Phản ứng oxi hóa
Rượu Etylic có thể cháy một cách dễ dàng khi rót vài giọt vào chén sứ. Tuy không có khói được sinh ra nhưng ngọn lửa sẽ có màu xanh da trời đặc trưng và tỏa ra lượng nhiệt đáng kể. Phương trình phản ứng:
C2H5OH + 302 → 2CO2 + 3H2O
4. Các phương pháp điều chế rượu Etanol
Trước khi trở thành một thành phần không thể thiếu trong các ngành công nghiệp, quá trình điều chế rượu Etanol được trải qua hàng loạt những phát triển và cải tiến đầy thú vị, từ truyền thống đến hiện đại nhờ công nghệ tiên tiến.
4.1. Lên men từ hạt và các loại trái cây
Cồn Ethanol sử dụng phổ biến trong các loại đồ uống có cồn như rượu bia được sản xuất bằng phương pháp lên men. Men rượu sau khi chuyển hóa đường trong điều kiện không có oxy sẽ sản sinh ra Ethanol và Cacbon Dioxit (CO2).
C6H12O6→ 2 CH3CH2OH+ 2 CO2
Quá trình nuôi cấy men theo từng điều kiện khác nhau để sản xuất rượu được gọi là ủ rượu và nồng độ rượu ở mỗi sản phẩm có thể tăng lên nhờ chưng cất. Để sản xuất cồn Ethanol từ những nguyên liệu chứa tinh bột như hạt ngũ cốc hoặc nho, táo,… chẳng hạn như các dòng vang và Whisky hiện nay thì tinh bột và trái cây phải được chuyển hóa thành đường. Điều này sẽ được tạo ra bằng cách cho ủ mạch nha giúp sản sinh ra các enzym có chức năng phá vỡ tinh bột và chuyển hóa thành đường.
Men rượu khi chế biến rượu Whisky cũng được chưng cất từ nấm men Saccharomyces Cerevisiae, vừa tạo ra rượu vừa sản sinh ra nhiều sản phẩm phụ có mùi như Ester. Tùy thuộc vào khoảng thời gian lên men mà rượu được tạo ra sẽ có nhiều hương vị đa dạng khác nhau.

4.2. Công nghệ dầu hóa Hydrat hóa Etylen
Hydrat hóa ethylene là phương pháp công nghiệp phổ biến để sản xuất etanol (cồn Etylic) từ khí ethylene (C2H4). Quá trình này diễn ra trong điều kiện nhiệt độ và áp suất cao, với sự hiện diện của chất xúc tác axit.
H2C = CH2 + H2O → CH3CH2OH
Chất xúc tác thông thường sẽ là Acid Phosphoric được hút bám trong chất có độ xốp cao như Diatomit. Công nghệ này lần đầu tiên được thực hiện vào năm 1930 bởi Union Carbide. Ethylene sẽ được Hydrat hóa gián tiếp qua phản ứng với Acid Sulfuric đậm đặc để tạo ra chất Ethyl Sulfat. Sau đó, chất này sẽ được thủy phân một lần nữa nhằm tạo ra Ethanol và tái tạo lại Axit Sunfuric. Tuy nhiên, phương pháp này hiện gần như đã bị loại bỏ.
H2C = CH2 + H2SO4 → CH3CH2OSO3H
CH3CH2OSO3H + H2O → CH3CH2OH + H2SO4
4.3. Etanol và nước
Khi điều chế rượu bằng Etanol và nước cần lưu ý đến điểm sôi cực đại của hỗn hợp ở nồng độ 96% Ethanol và 4% nước. Khi chưng cất phân đoạn hỗn hợp Ethanol-nước không thể tạo ra Ethanol tinh khiết hơn 96%. Cũng vì vậy mà 95% Ethanol trong nước là dung môi phổ biến nhất.
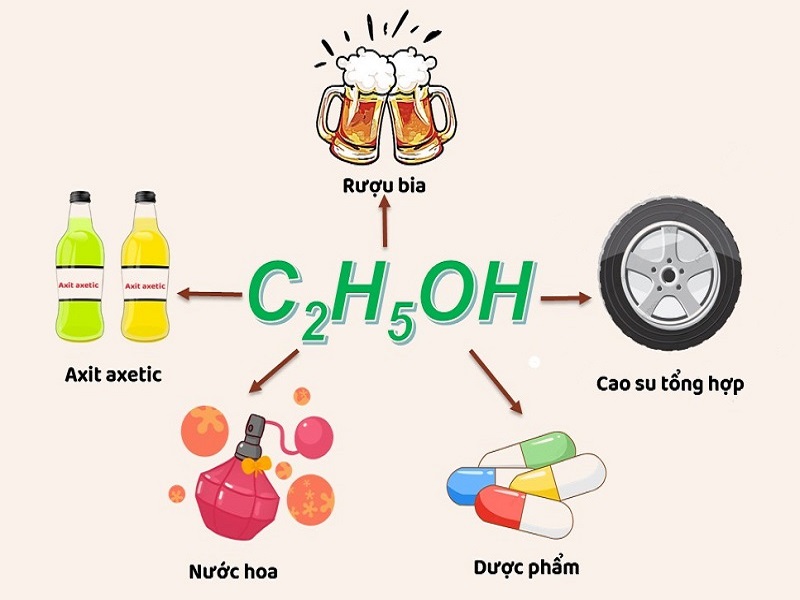
5. Ứng dụng của rượu trong đời sống và công nghiệp
Rượu không chỉ được xem là thức uống phổ biến trong đời sống mà còn là nguồn nhiên liệu hỗ trợ rất tốt cho quá trình sản xuất công nghiệp.
- Là nguyên liệu chính trong dây chuyền sản xuất nhiều loại dược phẩm, rượu bia, axit axetic, cao su tổng hợp và các thức uống có cồn khác.
- Được sử dụng làm dung môi để điều chế nước hoa, vecni nhờ khả năng hòa tan cực tốt.
- Etanol hay rượu Etylic cũng được ứng dụng trong nhiều quy trình công nghiệp khác nhau như chế tác các sản phẩm chống đông lạnh vì điểm đóng băng thấp nhất của rượu rơi vào khoảng -114 độ C.
- Ở nồng độ 70% Ethanol, rượu được dùng như chất tẩy uế, nồng độ 62% được sử dụng phổ biến ở các gel vệ sinh kháng khuẩn và khử trùng tốt nhất ở nồng độ 70%.
- Ngoài ra Ethanol còn có hiệu quả trong việc ngăn ngừa các loại vi khuẩn và vi nấm, rượu có thể giết chết các sinh vật này chủ yếu bằng phương pháp gây biến tính protein và hòa tan lipid ở chúng.
- Rượu còn được xem như nguồn nhiên liệu cho ngành hàng giao thông vận tải và đèn cồn trong phòng thí nghiệm.
- Công nghệ sản xuất cũng sử dụng rượu trong ứng dụng sản xuất Andehit Fomic, Formaldehyde, Axit Axetic,…
- Rượu cũng đóng vai trò quan trọng trong ngành công nghiệp chất dẻo.
=> Bài viết liên quan:
- Cách khử Andehit trong rượu
- Nguồn gốc của rượu
- Quy trình sản xuất rượu
- Men rượu là gì? Công thức làm men rượu tại nhà
Câu thường gặp về công thức hóa học của rượu
Vì sao CTHH của rượu được viết dưới dạng C₂H₆O hoặc C₂H₅OH?
Hai công thức này đều biểu thị cùng một chất là rượu ethanol (hay rượu etylic). Tuy nhiên, C₂H₅OH thể hiện rõ hơn cấu trúc phân tử, gồm nhóm ethyl (CH₃–CH₂–) liên kết với nhóm hydroxyl (-OH), là đặc trưng của ancol. Còn C₂H₆O chỉ mô tả thành phần nguyên tử mà không thể hiện cấu tạo.
Làm thế nào để phân biệt rượu ethanol và methanol?
Bạn có thể dùng đồng(II) oxit (CuO) làm chất thử. Khi đun nóng, methanol bị oxi hóa tạo ra formaldehyde (HCHO) có mùi hăng mạnh, trong khi ethanol tạo acetaldehyde (CH₃CHO) có mùi ngọt nhẹ. Ngoài ra, methanol cực kỳ độc, chỉ cần uống vài ml có thể gây mù hoặc tử vong, trong khi ethanol là loại rượu an toàn được dùng trong đồ uống.
Ngoài phản ứng với axit axetic, rượu còn phản ứng với những hợp chất nào khác?
Rượu có thể phản ứng với nhiều loại axit hữu cơ khác (như axit propionic, axit butyric…) để tạo ra este có mùi thơm – thường dùng trong công nghiệp hương liệu và mỹ phẩm. Ngoài ra, rượu còn phản ứng với axit halogenhiđric (HCl, HBr, HI) để tạo ra dẫn xuất halogen như ethyl chloride (C₂H₅Cl).
Rượu có tính axit hay bazơ không?
Rượu là hợp chất trung tính, nhưng nhóm -OH trong rượu có thể thể hiện tính axit yếu. Vì thế, ethanol có thể phản ứng với kim loại mạnh như Na, K để tạo ra muối ancolat và giải phóng khí H₂. Tuy nhiên, tính axit của rượu yếu hơn nước.
Có phải tất cả các loại rượu đều có công thức hóa học giống nhau không?
Không. “Rượu” là tên gọi chung của nhóm hợp chất ancol. Mỗi loại rượu có công thức khác nhau tùy theo số nguyên tử carbon trong phân tử. Ví dụ:
- Rượu methanol: CH₃OH
- Rượu ethanol: C₂H₅OH
- Rượu propanol: C₃H₇OH
- Rượu butanol: C₄H₉OH
Trong thực tế, chỉ ethanol là loại được phép sử dụng trong đồ uống.
Rượu có hòa tan được chất béo không?
Có. Dựa vào cấu trúc phân tử C2H5OH, rượu Ethanol có hai đặc tính trái ngược:
- Nhóm -OH phân cực giúp hòa tan được các chất vô cơ và phân cực (như nước).
- Mạch C₂H₅ kỵ nước giúp hòa tan được chất béo và tinh dầu.
Nhờ tính chất đặc biệt này, Ethanol được sử dụng phổ biến trong sản xuất mỹ phẩm, nước hoa, dược phẩm và dung môi chiết xuất hương liệu tự nhiên.
Vì sao rượu Ethanol được gọi là “Ancol no, đơn chức”?
Tên gọi này bắt nguồn từ cấu trúc hóa học của Ethanol (C2H5OH).
- “Ancol no” vì mạch hiđrocacbon không có liên kết đôi hoặc ba (chỉ chứa liên kết đơn).
- “Đơn chức” vì phân tử chỉ chứa một nhóm chức -OH.
Do đó, Ethanol được xếp vào nhóm Ancol no, đơn chức trong hóa học hữu cơ.
Ethanol có gây ăn mòn kim loại không?
Trong điều kiện bình thường, Ethanol tinh khiết không ăn mòn kim loại. Tuy nhiên, khi có nước, axit hoặc tạp chất, Ethanol có thể phản ứng nhẹ và gây ăn mòn các kim loại như sắt, đồng hoặc kẽm. Vì vậy, trong công nghiệp, Ethanol thường được bảo quản trong bình thủy tinh hoặc thùng thép không gỉ để giữ độ tinh khiết và tránh phản ứng phụ.
Rượu 96 độ có uống được không?
Không nên uống. Rượu 96 độ là Ethanol gần như tinh khiết, thường dùng trong y tế, công nghiệp và thí nghiệm. Nếu uống phải, Ethanol ở nồng độ cao có thể gây bỏng niêm mạc, rối loạn thần kinh và ngộ độc cấp tính. Rượu uống thông thường chỉ nên có nồng độ dưới 45 độ để đảm bảo an toàn cho sức khỏe.
Vì sao uống nhiều rượu lại gây say và hại gan?
Khi vào cơ thể, Ethanol được gan chuyển hóa thành Acetaldehyde – một chất độc hại và gây tổn thương tế bào gan. Acetaldehyde còn ảnh hưởng đến não bộ và hệ thần kinh trung ương, khiến người uống có cảm giác chóng mặt, buồn nôn, mất kiểm soát. Nếu uống nhiều trong thời gian dài, gan phải làm việc quá tải, dễ dẫn đến gan nhiễm mỡ, xơ gan hoặc nghiện rượu mạn tính.
Nắm vững công thức hóa học của rượu cũng như phương pháp điều chế một cách toàn diện có thể giúp bạn tạo ra những ứng dụng mới mẻ hơn, không chỉ trong ngành công nghiệp đồ uống mà còn ở nhiều khía cạnh khác trong đời sống. Mong rằng bài viết này của Wine VN đã mang đến những thông tin hữu ích. Để cập nhật những kiến thức hay về rượu, bạn đọc hãy thường xuyên truy cập vào website Winevn.com nhé!
>>> Xem thêm các loại rượu phổ biến nhất trên thị trường:

Nhà sáng lập kiêm Giám đốc điều hành hệ thống cửa hàng rượu WineVN, trực tiếp định hướng chiến lược sản phẩm và cố vấn nội dung về rượu vang nhập khẩu, rượu mạnh cao cấp và quà tặng doanh nghiệp trên winevn.com. Với hơn 15 năm kinh nghiệm, tôi có kiến thức thực tiễn sâu rộng về thị trường và đặc biệt am hiểu phân khúc rượu ngoại, quà biếu cao cấp.







